Острый респираторный дистресс-синдром
| Острый респираторный дистресс-синдром | |
|---|---|
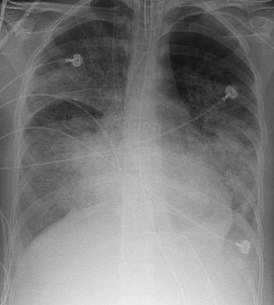 Рентгенограмма органов грудной клетки пациента с ОРДС | |
| МКБ-10 | J80. |
| МКБ-10-КМ | J80 |
| МКБ-9 | 518.5, 518.82 |
| DiseasesDB | 892 |
| MedlinePlus | 000103 |
| eMedicine | med/70 |
| MeSH | D012128 |
О́стрый респирато́рный дистре́сс-синдро́м (ОРДС, респираторный дистресс-синдром взрослых) — жизнеугрожающее воспалительное поражение лёгких, характеризующееся диффузной инфильтрацией и тяжёлой гипоксемией. Данное патологическое состояние вызывается множеством причин, которые напрямую или косвенно поражают лёгкие. ОРДС часто приводит к смерти, требует проведения интенсивной терапии и искусственной вентиляции лёгких.
Содержание
История и определение
Впервые клинические проявления ОРДС были описаны в 1967 году у 12 пациентов, семь из которых погибли. Тогда был применён термин респираторный дистресс-синдром взрослых. В дальнейшем данное состояние получало множество других названий — некардиогенный отёк лёгких, «мокрое лёгкое», «тяжёлое лёгкое», «шоковое лёгкое».
В 1994 году на Американо-Европейской согласительной конференции (АЕСК) было предложено новое название заболевания — ОРДС. Согласно АЕСК ОРДС — острое состояние, характеризующееся двусторонней инфильтрацией лёгких и тяжёлой гипоксемией при отсутствии признаков кардиогенного отёка лёгких.
Эпидемиология
В США наблюдается около 190 000 случаев ОРДС в год. Ранее смертность от ОРДС была высока. С улучшением лечения в последние годы она снизилась до примерно 35—40%. Примерно 10% всех пациентов отделений интенсивной терапии страдают от острой дыхательной недостаточности, 20% среди которых — подходят под критерии ОПЛ или ОРДС.
Этиология
ОРДС возникает в результате прямого или непрямого повреждения лёгких. Непрямое повреждение лёгких возникает в результате системной воспалительной реакции при внелёгочных заболеваниях. К наиболее частым причинам относят сепсис и/или пневмонию (в том числе аспирационную), тяжёлые травмы. Другие причины представлены в таблице.
| Прямое повреждение лёгких | Непрямое повреждение лёгких |
|---|---|
| Аспирация | Сепсис |
| Пневмония | Тяжёлая травма |
| Диффузное альвеолярное кровотечение | Пересадка костного мозга |
| Жировая эмболия | Ожоги |
| Пересадка лёгких | Кардиопульмональный шунт |
| Утопление | Передозировка лекарств (аспирин, кокаин, опиоиды, фенотиазины, трициклические антидепрессанты) |
| Ушиб лёгкого | Массивное переливание крови |
| Вдыхание токсичного газа | Неврогенный отёк лёгких в результате инсульта, судорог, травмы головы |
| Панкреатит | |
| Рентгеноконтрастные препараты (редко) |
Патогенез
В основе ОРДС лежит диффузное воспаление лёгких. В этом процессе выделяют 3 фазы: экссудативная, пролиферативная и фибротическая.
В экссудативную фазу в ответ на воспаление выделяются цитокины и другие провоспалительные вещества, которые активируют альвеолярные макрофаги и циркулирующие нейтрофилы. В свою очередь, активированные нейтрофилы прикрепляются к эндотелию лёгочных капилляров и высвобождают содержимое своих цитоплазматических гранул (протеазы и токсические метаболиты кислорода). Это приводит к повреждению эндотелия капилляров и эпителия альвеол, нарушая альвеолярно-капиллярный барьер. В результате экссудат проникает в лёгочную паренхиму и альвеолярное воздушное пространство. Нарушается газообмен и возникает гипоксия. Также возможно повреждение альвеолоцитов II типа, которые отвечают за образование сурфактанта. При этом происходит спадение альвеол, снижение растяжимости лёгких и внутрилёгочное шунтирование. Кроме того, развивается лёгочная гипертензия в результате внутрисосудистой обструкции тромбами, спазма лёгочных сосудов из-за гипоксии и действия некоторых воспалительных медиаторов (тромбоксан, лейкотриены и эндотелин).
В пролиферативную фазу у большинства пациентов происходит восстановление лёгких: удаляется экссудат, нейтрофильная инфильтрация сменяется лимфоцитарной. Пролиферируют альвеолоциты II типа, которые образуют новый сурфактант и дифференцируются в альвеолоциты I типа. Но несмотря на такие улучшения, у многих больных сохраняется одышка, тахипноэ, гипоксемия. У некоторых пациентов процесс переходит в фибротическую фазу. Накопленный в лёгких фибрин подвергается ремоделированию и может вызывать фиброз.
Клиническая картина
ОРДС чаще возникает в первые 12—48 часов от начала основного заболевания (в некоторых случаях через 5—7 дней). Больной может жаловаться на одышку, дискомфорт в грудной клетке, сухой кашель. При его осмотре выявляют тахипноэ, тахикардию, участие вспомогательных мышц в дыхании, цианоз кожного покрова. При аускультации можно выявить двусторонние хрипы.
Диагностика
АЕСК опубликовала критерии диагностики ОРДС.
| Диагностические критерии ОРДС |
|---|
| Острое начало |
| Наличие предрасполагающего фактора |
| Двусторонние инфильтраты на рентгенограмме лёгких |
| PaO2/FiO2 <200 мм рт.ст. при ОРДС и <300 при ОПЛ |
| Нет признаков левожелудочковой недостаточности (отсутствие клинических данных или давление заклинивания лёгочной артерии не выше 18 мм рт.ст.) |
ОПЛ (острое повреждение лёгких) — более лёгкая форма ОРДС; PaO2 — парциальное давление кислорода в артериальной крови (мм рт.ст.); FiO2 — фракционная концентрация кислорода во вдыхаемом газе (десятичной дробью, например 0,5)
Обнаруживают прогрессирующую гипоксемию (SpO2 ниже 90%), которая часто рефрактерна к ингаляциям кислорода. При исследовании газов артериальной крови на начальных стадиях ОРДС выявляют низкое PaO2, нормальное или низкое РаСО2 и повышение рН (алкалоз). В последующем РаСО2 нарастает и алкалоз сменяется ацидозом.
При рентгенографии лёгких видны двусторонние диффузные инфильтраты, иногда — плевральный выпот. Такие признаки неспецифичны и также характерны для кардиогенного отёка лёгких, что затрудняет дифференциальную диагностику. Компьютерная томография показывает негомогенную инфильтрацию лёгких в определённых отделах (в задненижних отделах у лежачих больных). Это объясняется зависимым от силы тяжести распределением отёка лёгких и сдавлением вышележащими отёчными отделами лёгких.
Бронхоальвеолярный лаваж — наиболее надёжный метод диагностики ОРДС. При этом вводят гибкий фибробронхоскоп в один из поражённых сегментов лёгких. Затем промывают лёгочный сегмент изотоническим раствором и анализируют состав промывной жидкости. У больных с ОРДС обнаруживают нейтрофилы, составляющие 60—80% всех клеток промывной жидкости (в норме <5%).
Лечение
Лечение в первую очередь направлено на устранение заболевания, приведшего к ОРДС. Если это невозможно (например, после массивных переливаний крови, аортокоронарного шунтирования и т.д.), то ограничиваются поддерживающей терапией.
Искусственная вентиляция лёгких
Стандартные объёмы искусственной вентиляции лёгких (ИВЛ) составляют 10—15 мл/кг. При ОРДС функционирует только непоражённая область лёгких, то есть ёмкость лёгких снижена, поэтому большие объёмы ИВЛ вызывают перерастяжение и разрыв дистальных воздушных пространств (волюмотравма). Кроме того, при ИВЛ возможна баротравма (при высоком уровне давления в дыхательных путях), ателектотравма (вследствие циклических расправлений и спадений альвеол) и биотравма (высвобождение провоспалительных цитокинов нейтрофилами в ответ на ИВЛ). Все эти повреждения объединяют под понятием вентилятор-ассоциированное повреждение лёгких.
В крупном исследовании, проведённым Клиническим обществом по ОРДС (англ. ARDS Clinical Network), было показано снижение смертности при вентиляции низкими объёмами (6 мл/кг и давление плато не выше 30 мм вод.ст.). Также такой режим ИВЛ снижает риск развития биотравмы. Однако при вентиляции низкими объёмами возникает гиперкапния и дыхательный ацидоз. Поэтому говорят о допустимой гиперкапнии, что означает допущение определённой гиперкапнии для сохранения щадящего режима вентиляции лёгких. Точные показатели неизвестны, но илледования показывают, что для большинства пациентов допустимы будут уровни PaCO2 (парциальное давление углекислого газа в атериальной крови) 60—70 мм рт.ст. и артериального pH 7,2—7,25.
ИВЛ применяют в режиме положительного давления в конце выдоха (ПДКВ, англ. PEEP) для улучшения оксигенации. ПДКВ предупреждает развитие ателектотравмы и позволяет снизить FiO2, тем самым предотвращая повреждение альвеол высокими концентрациями кислорода. Однако высокие значения ПДКВ могут приводить к перерастяжению альвеол и снижению сердечного выброса, поэтому рекомендуют начинать с малого уровня ПДКВ — 5 см вод.ст., при необходимости постепенно повышая до 20—24 см вод.ст. Есть также способ подбора ПДКВ на основе построения сигмоидальной кривой "давление-объём".
